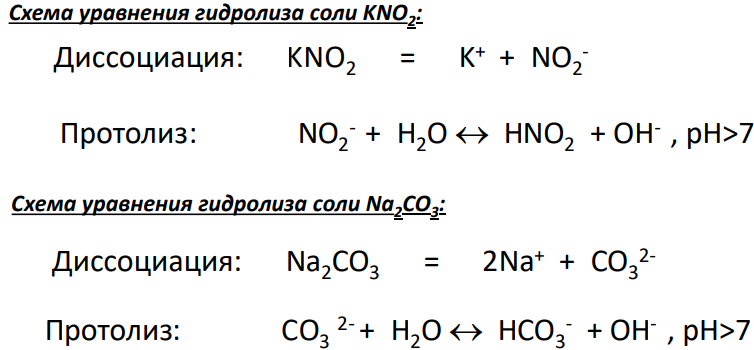Диссоциация воды и pH
Результаты освоения модуля. Сокращения и обозначения. Физические свойства воды.





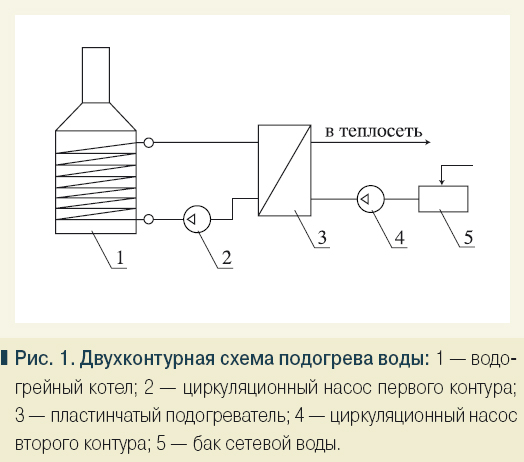

Что такое жидкость Жесткость воды Тяжёлая вода Минеральная вода Концентрация растворов Вода и измерения Структура воды Диссоциация воды и pH Водородная связь Молекула воды Физические свойства воды Химический состав воды Электролитическая диссоциация Электропроводность растворов Диссоциация воды и pH Диссоциация воды pH воды Ион гидроксония Подвижность ионов гидроксония и гидроксид-ионов Диссоциация воды Чистая вода, хоть и плохо по сравнению с растворами электролитов , но может проводить электрический ток. Другими словами скорости обоих процессов будут равны. В зависимости от pH растворы делят на нейтральные, кислые и щелочные. От pH раствора очень сильно зависит протекание многих химических реакций, как на уровне процессов проводящихся в лаборатории и на производстве, так и на уровне реакций в живых организмах, поэтому химикам и биологам с водородным показателем иметь дело приходится очень часто. Все обитатели природных вод и почв адаптированы к определенному водородному показателю, и в случаи его изменения могут погибнуть. Большинство живых организмов могут существовать лишь в средах, близких к нейтральным.
- В результате каждый ион образует вокруг себя как бы «атмосферу» из ионов другого знака. Эта ионная атмосфера препятствует передвижению ионов в растворе, понижая его электропроводность.
- Вода является слабым электролитом и в незначительной степени диссоциирует на ионы по реакции;. В знаменателе дроои - концентрация недиссоциированных молекул воды, которую можно считать постоянной и определить в I литре, приняв массу 1 л воды за г.
- Пренебрегая концентрацией диссоциированных молекул воды и принимая массу 1 л воды за г получаем:.








Задачи для самостоятельного решения. Ионное произведение воды равно:. Для разбавленных водных растворов ионное произведение воды не зависит от состава раствора и постоянно при данной температуре. Процесс диссоциации Н 2 О идет с поглощением теплоты, поэтому при повышении температуры в интервале от 0 до о С величина К w увеличивается.